21世紀經濟報道記者 唐唯珂 鹿思佳 廣州報道 國內新冠病毒抗原檢測正式走向大眾。
3月12日,國家藥監局發布通告,批準南京諾唯贊、北京金沃夫、深圳華大因源、廣州萬孚生物、北京華科泰生物的新冠抗原產品自測應用申請變更。自此這五款新冠抗原自測產品可正式面向普通民眾上市銷售。
此前3月11日,國家衛健委官網公布了《關于印發新冠病毒抗原檢測應用方案(試行)的通知》(以下簡稱為《通知》)。《通知》表示,國務院決定在核酸檢測的基礎上,增加抗原檢測作為補充。社區居民有自我檢測需求的,可通過零售藥店、網絡銷售平臺等渠道,自行購買抗原檢測試劑進行自測。
這意味著新冠抗原自測模式在國內的正式落地。此前國內新冠病毒檢測主要是以核酸檢測為主,隨著國家批準應用新冠抗原檢測,后續相關產品國內注冊審批上市速度也會進一步加快,將給體外檢測行業帶來新的巨大增長點。
此外,國內新冠抗原檢測產品在線上線下零售渠道上市銷售工作已經啟動。
抗原檢測為補充 核酸檢測仍為金標準
國內常說的核酸檢測,全稱為聚合酶鏈式反應(PCR)檢測技術,本質上是一種基因擴增技術。也就是,將新冠病毒RNA片段逆轉錄成雙鏈DNA,再通過DNA聚合酶進行擴增,將攜帶病毒的基因片段不斷放大,然后通過一種熒光探針來捕捉,當擴增后的病毒濃度達到一個臨界值時,會有熒光信號提示,意味著樣本中存在新冠病毒。
國外所用的家庭自助檢測,是一種抗原檢測技術。新冠病毒感染人體后,其病毒蛋白可作為抗原,刺激人體細胞產生特異性抗體。抗原檢測就是利用病毒抗原和抗體相結合的原理,去檢測人們的口鼻分泌物中是否有病毒抗原。
復旦大學附屬華山醫院感染科主任張文宏此前表示:“抗原就像是病毒外面穿的‘衣服’,核酸就是病毒里面的基因。抗原的檢測方法,是從抗體出發去測‘衣服’,綜合特異性之后,就可以讓病毒顯示出來。核酸檢測,需要通過擴增來完成,檢測敏感性更高,但獲得結果所需時間也更長。”

(21世紀經濟報道記者根據公開資料整理。核酸價格根據此前2021年底廣東省發展改革委、廣東省財政廳發布的《關于進一步降低疾控機構新冠病毒核酸檢測收費標準的通知》;抗原檢測價格根據FDA批準的新冠自檢試劑盒售價統計得出)
早前歐洲、美國、日本、印度等都在大力推行家庭自助檢測。英國從2020年11月起就開始推廣快速抗原檢測,居民在網上申請后,檢測試劑包郵到家。2022年初,每個美國家庭可以網上預約4次免費試劑盒,在家中完成自我檢測。
浙江大學附屬邵逸夫醫院檢驗科副主任吳勝軍指出,抗原檢測的準確性和很多因素有關,比如產品質量、采樣準確性。如果不是嚴格按照說明書來采樣操作,對檢測結果影響還是比較大的。
此次《通知》認可了核酸檢測的重要性,核酸檢測依然是新冠病毒感染的確診依據,抗原檢測作為補充手段可以用于特定人群的篩查,有利于提高“早發現”能力。《通知》的下發也意味著國內的新冠檢測市場將由核酸檢測“一家獨大”,過渡到“核酸檢測為主,抗原檢測為補充”的分級診斷階段。
關于抗原檢測的價格,香港大學醫學院教授、病毒學家金冬雁此前在接受采訪時分析稱,合理區間出廠價大約1人份5元,2人份8-10元,終端售價不超過20元/人份。但他也同樣表示:“就目前而言,抗原檢測的成本受生產規模、原料來源等因素的影響,目前成本上漲幅度較大,關鍵原材料供不應求。”
注冊審批速度加快
作為新冠防控的有效補充檢測方法之一,抗原居家檢測有望憑借其便捷、快速等優勢迎來市場的快速增長。
3月12日,國家藥監局批準北京華科泰生物、南京諾唯贊、北京金沃夫、深圳華大因源、廣州萬孚生物的新冠抗原產品自測應用申請變更。自此,五款新冠抗原產品正式上市,技術路徑覆蓋膠體金、乳膠、熒光免疫層析等對儀器環境和操作要求相對簡單的多個類型,為《方案》中到基層醫療衛生機構就診人員開展新冠抗原快速檢測提供了可及的選擇。
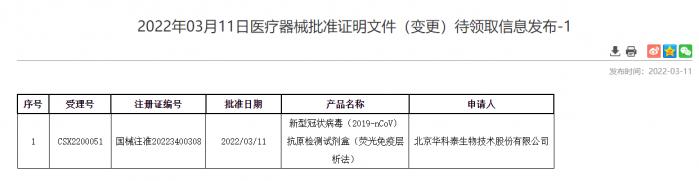
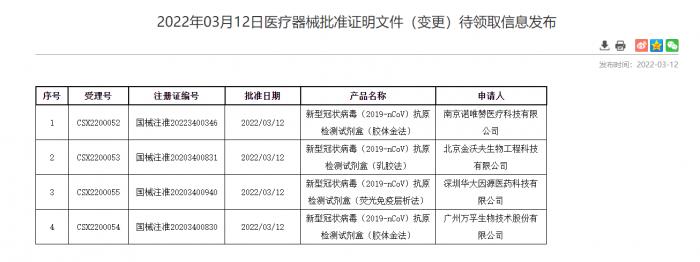
(圖:國家藥品監督管理局網站)
3月12日午間,央視新聞也報道稱,南京諾唯贊、北京金沃夫、華大因源、萬孚生物以及北京華科泰累計5款新冠抗原產品均獲批,且實現自測應用申請變更。
“此次注冊變更的核心在于是否真的不再限定該檢測試劑僅由專業技術人員使用。這意味著,注冊變更后,檢測試劑的使用范圍進一步擴大,擁有在零售藥店、網絡銷售平臺進行銷售的資格。 ”華南某體外檢測人士向21世紀經濟報道記者表示。
此前有媒體曝出,大參林與萬孚生物已經就新冠抗原自測試劑的分銷簽訂戰略合作協議,萬孚生物新冠抗原自測試劑將“首發”于大參林線下門店。
對此21世紀經濟報道記者求證萬孚生物方面,其回復到:12日晚間發布于萬孚生物公眾號的官方聲明,其中表示,對于未經公司合法授權、擅自通過電商以及其他線上渠道、宣稱可銷售我公司研發的新型冠狀病毒(2019-nCoV)抗原檢測試劑盒(膠體金法)產品的個人及公司,公司保留向相關公安部門報案并追究相應法律責任的權利。
此外,據老百姓大藥房集團公眾號,12日,老百姓大藥房(603883)與廣州萬孚生物達成合作,第一批新冠抗原快測產品已在物流運輸途中,預計近日將在門店上架銷售。首批產品將登陸老百姓大藥房位于上海、湖南、江蘇等12 個省市的門店。據其介紹萬孚生物的新冠抗原快測產品15分鐘就可以得出檢測結果。
據了解,此前國內獲批《醫療器械注冊證》的企業較少,是因為國內對新冠檢測產品的注冊審批更加嚴格。
國家藥監局此前提出的抗原檢測試劑注冊技術審評要點,要求根據前期研究情況確定,入組病例或達到500人。而歐美對新冠抗原自檢試劑盒的臨床要求,參照了WHO的臨時指導文件,包括靈敏度、特異性、陽性符合率、陰性符合率等核心指標,但對臨床入組人數沒有嚴格規定。
最新獲批上市的5款新冠抗原檢測試劑盒產品也說明,隨著我國抗原檢測的放開,國內注冊審批速度也在加快。
市場逐步釋放?
在最新獲批上市的5家公司中,萬孚生物(300482)、深圳華大因源其控股公司華大基因(300676)、諾唯贊(688105)均為A股公司,而北京金沃夫和北京華科泰生物尚未登陸資本市場。
此前,諾唯贊披露了2021年業績快報。報告顯示,去年全年公司實現營業收入18.64億元,較上年同期增長19.13%,其中新冠相關業務(包括診斷原料及終端檢測試劑)的銷售收入實現約11.46億元,占營業收入的比重達61.48%。
據悉,報告期內得益于我國新冠防疫政策,公司常規業務主要客戶群體的業務開展在報告期內得以及時回歸常態與復蘇。公司涵蓋科研試劑、測序試劑、診斷原料、診斷試劑及儀器、CRO服務等在內的常規業務實現銷售收入7.18億元,相對2020年度同期增長約92%。
在新冠業務領域,公司主要提供新冠核酸檢測的酶原料以及新冠抗體/抗原檢測試劑盒。新冠核酸檢測酶原料產品主要為公司生物試劑產品中的PCR系列、qPCR系列和逆轉錄系列。公司抗體/抗原試劑盒以海外出口為主,已取得所需的海外注冊準入,結合海外近期疫情反復,預計相關檢測試劑的出口仍具有一定的持續性。
華大基因公布的年度業績快報顯示,2020年,華大基因實現營業收入和凈利潤分別為83.97億元和21.02億元,同比增長199.86%和656.43%。其中,來自精準醫學檢測綜合解決方案的收入同比大增8.7倍;感染防控類服務的收入同比大增7.2倍。
萬孚生物專業從事快速診斷試劑及配套儀器的研發、制造、營銷及服務,其3月8日在投資者互動平臺表示,2021年前三季度公司新冠業務實現收入約為8億元,其中大部分來自于新冠抗原自測產品的海外銷售貢獻。
除前述首批5家企業外,我國已有多家企業可量產抗原檢測試劑盒,但此前相關產品主要用于出口。據海關總署發布,2021年中國累計向海外出口668.93億元金額的新冠檢測試劑盒,2021年12月全國新冠試劑出口單月超100億元。
1月14日,九安醫療宣布其子公司已與美國ACC簽署抗原自測試劑盒采購合同并生效,合同價稅合計金額高達12.75億美元,合81.02億元人民幣。
除了九安醫療,東方生物等公司亦獲得了新冠抗原家用自測產品在美國等EUA(緊急使用授權);在歐洲,萬孚生物、東方生物、基蛋生物等公司新冠抗原家用自測產品獲得CE認證。
中泰證券研究所統計顯示,從全球范圍來看,目前已有200多家企新冠抗原試劑盒上市銷售,其中國產品牌憑借行業領先的檢驗效果以及生產供應能力迅速占領海外市場,獲批數量占半數以上。
隨著全球疫情反復,各地對病毒檢測需求持續增長,抗原檢測市場廣闊。以美國為例,根據PolarisMarketResearch數據顯示,2020年美國新冠抗原檢測市場規模為5.2億美元,預計2021年市場規模能達到45.6億美元,2022年達87.0億美元。
隨著政策落地,國內對抗原檢測試劑的需求量將大幅增加。中泰證券在研報中指出,參考海外發放政策,隨著國內抗原自檢試劑盒正式放開,預計國內新冠抗原自檢試劑盒市場單月規模有望達177-266億元,年市場規模將達到2124-3192億元。
國家藥監局網站顯示,當前,國內累計有超30款新型冠狀病毒2019-nCoV核酸檢測試劑盒獲批。其中,涉及的上市公司包括明德生物、邁克生物、達安基因、圣湘生物、碩世生物、安圖生物、東方生物、之江生物。在前述公司中,不乏盈利能力從千萬增長破億乃至幾十億且近三年業績持續增長的案例。當前,抗原檢測試劑盒目前的獲批數量遠不如核酸檢測試劑盒。
但此前一位體外診斷試劑領域的分析人士認為,由于抗原檢測試劑的技術門檻不高,這些廠商可能會很快推出自己的抗原檢測產品。并且未來這些產品的采購量如何,疫情防控政策是否會有更新的規定,以及實際規定運用的檢驗檢測場景都會影響相關公司業績。
廣州醫科大學附屬市八醫院感染病中心首席專家蔡衛平則表示,已經在國外市場獲得肯定的企業會占據一定優勢。原因在于,其通過的歐盟及美國食品藥品監督管理局(FDA)應急使用許可含金量較高,也有現成的海外臨床試驗數據可用,部分材料可以直接用以國內申請,預計這部分廠商會積極爭取國內上市的機會。


















 粵公網安備 44010402000579號
粵公網安備 44010402000579號