冉明東 吳錦葭(中南財經政法大學 湖北省醫療保障改革發展研究院)
2025年5月,一紙公告在全球醫藥圈掀起漣漪:三生制藥將一款尚處臨床階段的PD-1/VEGF雙抗候選藥物,以首付款12.5億美元、總金額60.5億美元授權給輝瑞,創下國產創新藥出海的新紀錄。6月2日,普米斯生物開發的PD-L1/VEGF雙抗PM8002,繼被BioNTech收購后,又以111億美元的高價轉授百時美施貴寶(BMS),完成估值五倍放大。這兩起交易接連登上各大財經、醫藥頭條,引燃了資本市場對中國Biotech(生物技術)的熱情。
恒生創新藥指數年內上漲超70%,領漲整個港股市場,一度被稱為“中國Biotech第二春”。不少投資者將目光重新投向創新藥賽道,仿佛重現2020年前后的一級市場盛況。
但熱潮尚未消退,爭議已悄然升溫。一部分聲音開始質疑,BD(商務拓展)熱潮是否意味著中國藥企在“賣青苗”?事實上,圍繞“賣青苗”的質疑,本身就包含兩個常見誤解。其一,是將BD交易誤讀為“整體出售”,仿佛中國Biotech將藥物和全部權益一并拱手相讓。實際上,多數授權交易采取的是license-out(授權輸出)模式,僅涉及海外市場的商業權利,國內權益仍由企業保留。與此同時,還有大量中國藥企通過license-in(授權引進)方式引入海外資產,實現“引進來、走出去”的協同。這種安排類似于電影發行中對海外放映權的分區授權,是資源全球配置的常規做法。其二,是誤以為BD交易的標的是“已開發成熟的產品”,好像中國企業正在賤賣“快收割的莊稼”。而真實情況是,當前多數BD項目的管線仍處于早期臨床階段,甚至不少尚在臨床前或Ⅰ期,Ⅲ期資產在交易中較為稀缺。這些授權的本質,是在巨大不確定性中,為高風險產品找到共享風險與投入資源的合作方,遠非“賣成品”,更像是共建未來可能性的風險合約。
從當前全球創新藥開發生態來看,十年以上的研發周期、超十億美元的投入、不到10%的成功率,幾乎已是常態。中國藥企雖然具備一定臨床推進和成本控制優勢,但要獨立承擔全球III期試驗、注冊、定價與商業化體系建設,仍面臨現實挑戰。在這種不確定性背景下,通過對外授權與全球巨頭資源協同、風險共擔,是合理的商業策略,是在權衡投入產出后所做出的理性選擇。
中國Biotech正處在“技術起勢—市場構建—制度對接”的產業過渡期。一部分企業選擇扎根國內、錨定醫保,構建本土商業化路徑;另一部分則借助BD策略,把全球化視為加速價值實現的杠桿,完全符合國際發展趨勢。摩根大通發布的研究報告表明,2025年第一季度的全球醫藥授權合作已成為大藥企獲取早期創新資產的主流路徑,全球交易總額達568億美元,其中首付款比例高達8%,約45億美元,顯示市場對早期資產的高度認可。大多數交易集中在臨床II期,首付款中位數達1.65億美元,遠高于臨床前項目,說明被授權資產仍處高度不確定階段,難以被稱為“青苗”。中國企業如三生制藥、普米斯等的交易金額雖創紀錄,但在全球范圍內屬于正常水平,類似規模交易在同期多有出現。此外,PD-1/VEGF、PD-L1/VEGF等雙抗藥物正是當下國際BD的熱點品類,表明中國Biotech已在全球關鍵技術賽道中占據一席之地。因此,中國制藥的BD熱潮是全球經驗、資本資源與制度環境共同作用的結果,而非哪一方單一因素的推動。
圖 1 2016-2025年第一季度研發許可交易總額與預付百分比

(數據來源:摩根大通)
圍繞“風險共擔、能力互補、優勢互換與融資轉軌”四個維度,有必要重估當下BD熱潮背后的產業邏輯。展望未來五年,中國創新藥是否能從不確定性中走出一條通往繁林的路徑?也許,這才是更值得我們追問的問題。在這個過程中,BD不是“賣青苗”的權宜之策,而是為可能長成的森林尋找光照、水源與時間的理性選擇。
BD邏輯:風險、能力、優勢、資本四維協同
創新藥出海,已經成為近五年中國Biotech最顯著的集體敘事。但在“License-out不斷刷屏”的背后,真正的問題并不在于交易的數量是否足夠、金額是否創紀錄,而在于:這些交易,到底意味著什么?它們是商業成功的起點,還是另一種形式的故事變現?在全球化的表象下,我們是否讀懂了BD的本質邏輯?帶著這些問題,我們嘗試從風險共擔、能力互補、優勢互換和融資轉軌等四個維度重新解構這場被資本與期待共同點燃的BD熱潮。
第一,風險共擔——在不確定中鎖定確定性收益。
“自研到底”聽起來令人振奮,但在創新藥產業,這往往不是通往成功的捷徑,而是一場資源透支與時間賽跑的豪賭。對于中國Biotech來說,選擇授權,并不是放棄未來,而是從一開始就對不確定性設下止損線——在大浪淘沙的賽道中鎖定當下可實現的收益,以換取持續生存的可能。
數據揭示了這條路徑的殘酷現實:全球候選新藥從I期走向最終上市的平均成功率只有7.9%。即便是中國資源最充沛的頭部Biotech企業,成功率也不過17%。這意味著,任何一個從II期向III期推進的項目,實質上都在面對巨大的不確定性——失敗不僅可能帶來研發沉沒成本的全面損失,也可能直接觸發企業現金流崩塌。
圖 2 2011-2020年項目各階段成功率
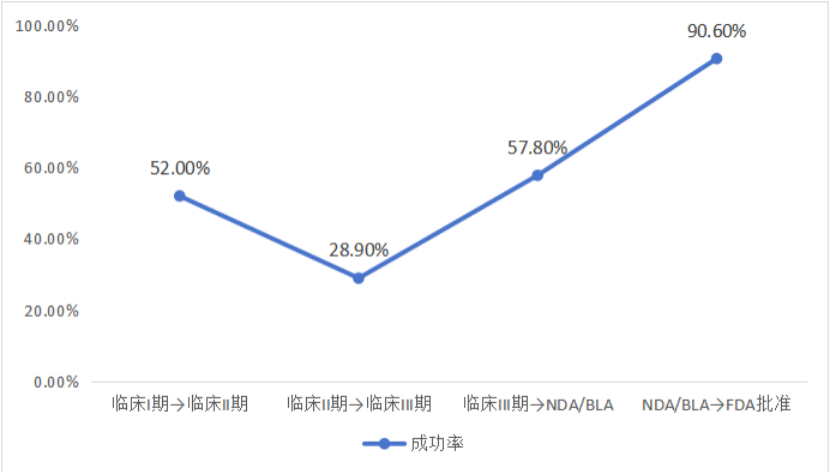
(數據來源:BIO(美國生物技術創新組織)-《Clinical Development Success Rates and Contributing Factors 2011–2020》)
在這樣的背景下,BD授權不是短視,而是一種清醒:用確定的現金流換取不確定的未來,在階段性節點“止盈”,避免孤注一擲。
但BD交易的意義遠不止于“回血”。它還是一種權威認定的信號機制。在市場不確定性放大的周期里,跨國藥企對某條管線進行高額授權,背后往往是對其技術平臺、數據可重復性、市場潛力等維度的全面盡調。這種來自全球藥業巨頭的“投票”,實質上是一種被市場解讀為“臨床-商業”雙重驗證的正向反饋,對于估值修復與下一輪融資具有放大效應。
針對“賣青苗”的指責,質疑者設想的前提是:中國Biotech已經擁有了全球III期臨床推進、海外注冊報批、準入談判、商業銷售的全套能力,理應守住全部價值。但這個假設與現實脫節。國際化能力的結構性缺失、全球臨床試驗費用的急劇攀升、歐美市場商業化路徑的復雜化,使得大多數Biotech根本無法獨立支撐一整條全球路徑。
更重要的是,所謂“青苗”的比喻本身就值得商榷。BD授權時的產品,大多尚處于臨床驗證階段,其安全性、有效性、適應癥拓展路徑仍具高度不確定性——它們還不能被稱為“青苗”,而是尚在播種與施肥之間的早期資產。不是“賤賣”,而是審慎交易。
在一個尚未建立穩定創新商業化路徑的市場中,授權交易是中國Biotech建立國際合作、引入資源、延長“研發生命”的必要機制。這不是對未來的放棄,而是對風險與能力邊界的精準識別。
第二,能力互補——用全球伙伴補上國際化短板。
在全球創新藥的戰場上,孤軍奮戰意味著極高的代價與極低的成功率。授權交易,并不是“賣掉機會”或“放棄能力”,而是將創新推向全球的一種協同機制——借助全球藥企的體系化能力,為中國Biotech補上國際化的關鍵短板。
不可否認,中國企業在新靶點發現、早期開發、臨床效率等方面展現出強勁勢能,但在真正決定產品能否進入國際市場的三個關鍵環節——全球III期臨床、注冊報批、商業化執行,仍需補上系統性能力缺口。
首先是全球臨床執行力有待加強。國際III期臨床需要在多個國家和地區設立幾十個中心,涉及上千名患者,執行成本高、管理難度大。康方生物AK112項目盡管國內數據優異,但其在海外的臨床策略偏窄、終點設置不理想,導致效果未達預期。這表明,國內經驗并不能無縫遷移到全球舞臺,尤其在多中心管理、患者異質性處理等方面更是難點密布。
其次是注冊報批體系的不對接。在中國積累的技術經驗,并不能輕松轉化為FDA(美國食品藥品監督管理局)或EMA(歐洲藥品管理局)認可的臨床路徑。相關數據顯示,FDA的新藥審評平均周期為10至15個月,如果遇到臨床設計爭議、資料補充要求或溝通節奏失誤,常常延遲至2年以上。再鼎醫藥這樣的行業領先者,推進全球報批時也常常需要借助合作方來應對語言、規范、法規等多重挑戰。更不用說資源更有限的中小Biotech,它們若無外部助力,常常面臨較高的溝通門檻。
而真正制約全球化的,是商業化體系的問題。一款新藥即便獲得上市許可,想要實現銷售與盈利,還需打通醫保準入、醫生教育、渠道建設、患者支持等多個環節。以美國市場為例,一款新藥上市后的推廣費用在數千萬至數億美元之間(營銷投入可能是研發成本的2–19倍),其中包括銷售團隊薪資、醫生關系建設、醫保談判及市場教育支出。在這一點上,跨國藥企擁有覆蓋上百國家的銷售隊伍、已建立的醫院和藥店網絡、與醫保談判的長期關系,構成了中國Biotech當前難以比肩的“護城河”。
有聲音質疑:既然能研發出高質量產品,為何不自己一步到位做全球化?這看似理性,實則忽略了資本與時間的約束現實。在當前全球融資退潮的環境中,僅一個國際銷售網絡的搭建,就需要至少5年以上的周期與數億美元的投入。而新藥的窗口期,往往不允許“邊學邊干”。若等待能力齊全再全球推進,可能早已被市場淘汰。
更值得厘清的是,授權并非“放棄控制權”,而是以合作實現產業效率的躍升。以PM8002為例,普米斯用5年時間建立臨床價值,BioNTech擁有歐美市場經驗與臨床體系,二者聯手后才能在短時間內完成全球轉授、技術放量與價值兌現。這并不是誰依附誰,而是典型的互利共贏。
“能力互補”從來不是妥協,而是全球醫藥產業分工深化后的合理選擇。在研發效率領先的今天,中國Biotech完全可以專注于早期管線與新機制突破,讓專業的人做專業的事。用合作換效率、用時間換空間,才是真正意義上的全球化戰略。
第三,優勢互換——釋放工程師紅利與優化資源配置。
創新藥產業從來都不是靠一個“爆款”支撐的單線博弈,而是一場多維度的系統運作。人才、資金、管線與產能的協同,是成敗的分水嶺。在全球資源緊縮、資本審慎的今天,將部分管線通過BD交易“戰略性外放”,不是削弱實力,而是在重新安排優先級,為企業爭取喘息窗口與戰略縱深。
中國Biotech之所以能在過去十年間迅速成長,很大程度上依賴于“工程師紅利”。據統計,中國藥物研發人員數量已經超過歐洲,逼近美國水平。與此同時,人均研發投入成本僅為歐美的1/3至1/2,與其形成鮮明對比的,是中國研發團隊平均年齡偏低(<35歲),勞動力市場流動性強、效率高。這種人才結構,為中國Biotech以“智力輸出”為核心的全球競爭能力奠定堅實基礎,形成了一種具備規模效應與迭代速度的創新系統能力。
圖 3 2023年我國醫藥人才年齡分布圖
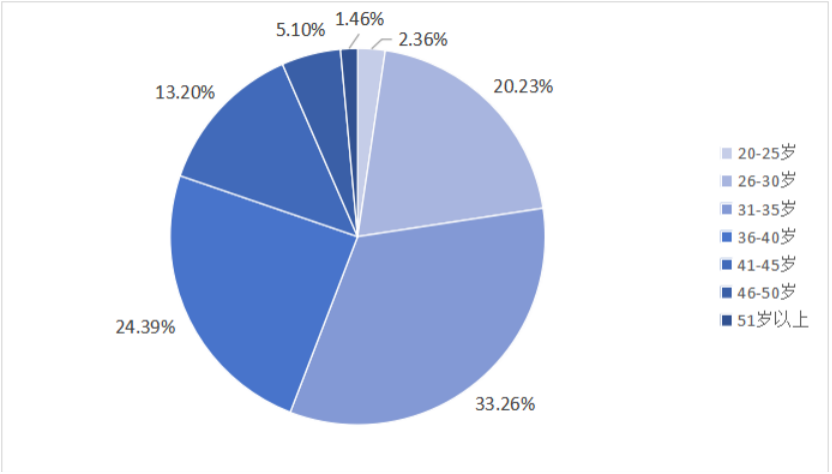
(數據來源:《2023年中國醫藥人才發展白皮書》)
這套系統讓中國Biotech可以在早期靶點探索、結構優化、候選藥篩選與臨床前模型驗證等環節中,以更快節奏推進多條管線,并構建“寬基多管線”戰略儲備。但與此同時,管線多也意味著資本消耗驚人,如何“以戰養戰”,成為企業管理層繞不開的現實問題。
恒瑞醫藥的案例提供了典型示范:其將GLP-1代謝類藥物管線授權給美國Kailera公司,換回一筆可觀的前期付款與里程碑金。這筆交易并未影響其在核心抗腫瘤ADC平臺的戰略推進,反而為后者提供了穩定現金流支持,構建起“資源錯配→資本重配→創新升級”的內部閉環。類似路徑也正在成為行業共識。這些策略背后的共通邏輯正是:以次級資產的局部退出,維持頭部產品的持續發力,從而在資源緊張期實現結構性前行。
這并不是“低價競爭”,而是制度與工程能力結合形成的體系化比較優勢。正因如此,授權交易不再是“賣掉希望”,而是主動利用優勢做資源再配置,提升系統運行效率,支撐重點突破項目沖擊全球舞臺。
第四,融資轉軌——資本鏈趨緊下的戰略突圍。
中國Biotech的融資故事,正在經歷一次根本性的劇變。
自2021年起,港股流動性急劇收緊、美聯儲持續加息等因素,導致境內外資本對生物醫藥板塊的風險偏好大幅下降。一級市場融資額度隨之下滑:2023年,中國創新藥領域一、二級市場融資總額降至約1040.82億元人民幣,相較2020年峰值銳減61%;而到了2024年,資本鏈進一步趨緊,這成為行業共同面臨的問題。
圖 4 2015-2024年中國創新藥領域一、二級市場融資金額
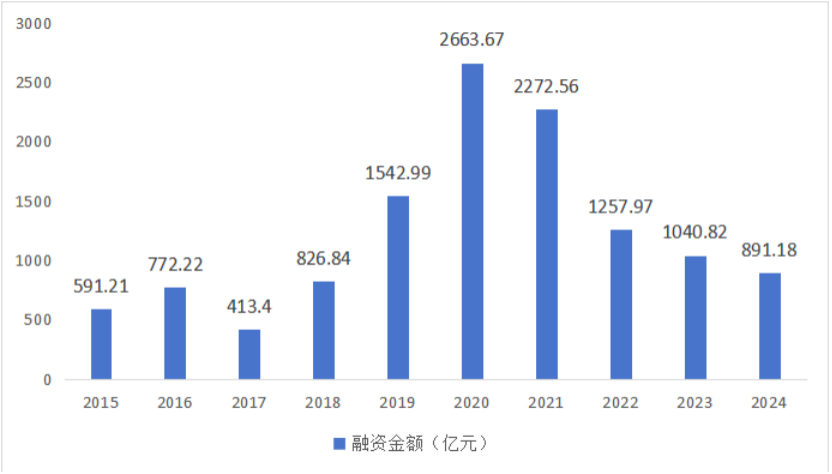
(數據來源:醫藥魔方)
圖 5 2015-2024年中國與海外創新藥并購事件數量
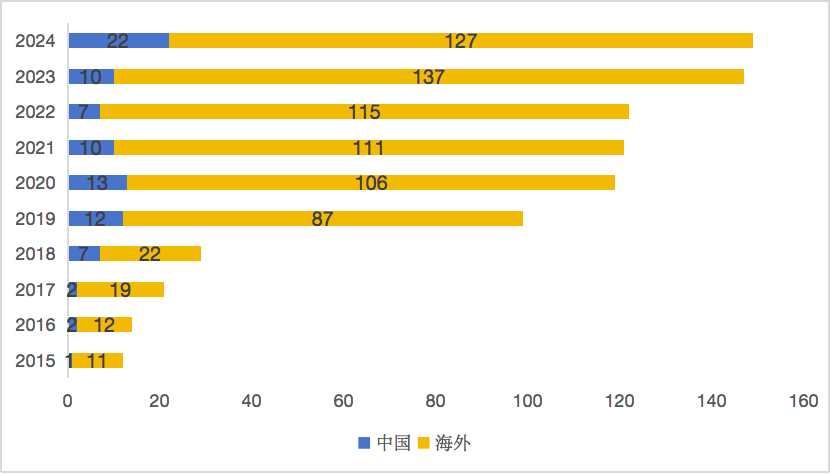
(數據來源:醫藥魔方)
在這樣的大背景下,授權交易(BD)不再是“融不到錢才做的備胎動作”,而正逐步成為繞開資本周期的戰略主航道。數據顯示,2023年中國創新藥企通過BD交易獲得的首付款總額超過210億元人民幣,首次超越當年IPO融資總額,打破“上市是唯一通路”的傳統認知。更值得注意的是,一批新型交易結構——如NewCo合資模式(藥企和投資方一起成立一家新公司,專門負責某個創新藥的研發和銷售)、區域性獨家授權平臺、雙邊收益綁定協議等——正在被廣泛采納。這些機制不僅嵌入歐美商業網絡和監管通道,也保障了中國藥企在全球推進中的主動權和長期收益權。
圖 6 2014-2024年中國醫藥BD交易數量
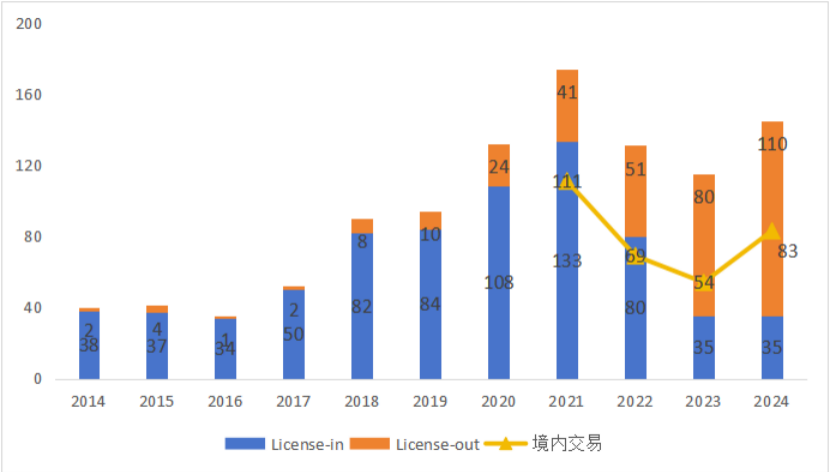
(數據來源:摩熵咨詢-《2024年醫藥企業綜合實力排行榜》)
有聲音質疑,BD只是“賤賣”與“斷臂求生”。但事實恰恰相反。在IPO面臨估值壓縮等局面下,BD反而提供了三重價值:第一,非稀釋性融資緩解現金流壓力;第二,引入戰略合作方分擔試驗與注冊風險;第三,通過與全球強者綁定,提升項目成功概率與產業鏈協同能力。更現實的是,在美元基金流入受限、海外審查趨嚴的政策環境下,BD是中國Biotech少有的仍可持續跨境推進的制度窗口。
更深層的轉變在于:BD正在從“單純融資工具”轉向“系統價值協同平臺”。它所激活的不只是現金流,更是國際資源、行業聲譽、人才流動與產業加速等要素的協同再分配。當生存邏輯從“等資本輸血”切換為“主動構建造血機制”,中國Biotech方有可能從資本周期的裹挾中掙脫出來,建立真正以產品、臨床價值和合作生態為核心的正向閉環。
因此,與其說BD是權宜之計,不如說它是資本退潮之后的一次產業戰略進化。當融資窗口不再一馬平川,誰能最早跳脫“IPO主導”的舊路徑,誰就能在周期谷底搶得新一輪上升的機遇。
三重路徑模式演進:中國創新藥全球化的轉變
路徑一:智力輸出——用工程師紅利“賣管線”。
在全球創新藥價值鏈上,中國Biotech正以“研發出口國”的新角色登場。工程師紅利、靶點創新、臨床早期能力,正成為中國“賣管線”的底氣,而非短視行為。
與其說中國在“賣青苗”,不如說在輸出“技術種子”。2025年,中國STEM(科學、技術、工程、數學)畢業生突破500萬人,AI藥物算法、靶點識別、抗體工程的早期人才儲備全球領先。國內外包服務體系更為Biotech提供了工業化落地的基礎設施,使其專注于價值密度更高的“前端環節”。
從信達生物CLDN18.2 ADC的臨床突破,到康方生物PD-1/VEGF雙抗的頭對頭挑戰帕博利珠單抗,再到石藥與阿斯利康的AI平臺交易——這一系列案例說明,中國Biotech已不再是“外包執行者”,而是成為全球藥企早期資產的重要供給方。
反方質疑這種交易“斷送了后市紅利”,但現實是:只有真正能推動早期臨床成功、被國際大藥廠選中接盤的資產,才可能真正走向全球市場。換言之,智力輸出不是甩賣,而是借力通關全球創新藥生態體系的必由之路。
中國研發+全球推進的組合,是當前全球創新藥版圖中最具現實性的合作模式,而“賣管線”不過是其制度形態之一。
路徑二:能力輸出——立足本土做全球“臨床樣板”。
過去,創新藥的臨床驗證中心在歐美;現在,中國正成為全球新藥“先試水、再出海”的首選場域。
得益于國家藥品監督管理局審批效率提升、患者招募能力強、試驗成本低,中國企業正通過“高質量本土試驗”構建全球認可的樣本數據體系。從榮昌泰它西普到君實、康方的多個管線,多數企業已放棄“等海外批”思維,轉向“國內主導+國際注冊”的協同布局。
這種能力輸出,改變了過去“海外設計—中國執行”的格局。中國Biotech的臨床策略設計、入組速度和數據質量已成為全球大藥廠的新依賴。這也是為何越來越多的License-out交易將“核心臨床主導權”保留在中國手中。
圖 7 2020-2024年中國License-out交易金額變化
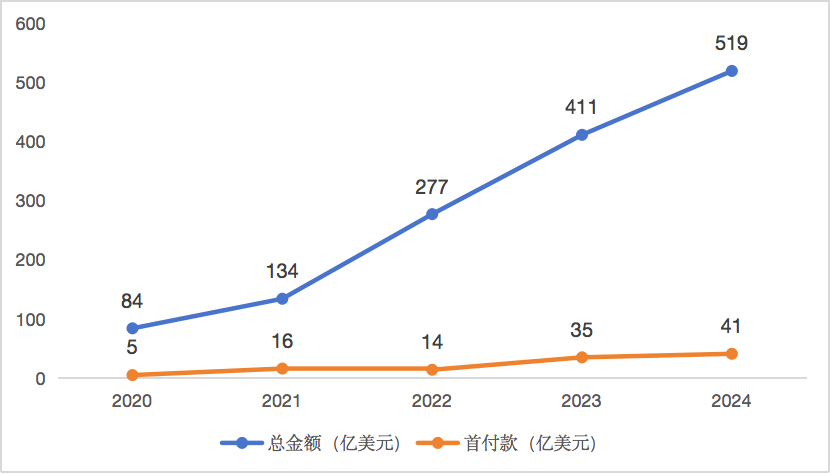
(數據來源:醫藥魔方)
從執行者到方案制定者,從價格洼地到策略策源,中國正在用試驗能力重塑全球藥品評估流程中的話語權。
路徑三:工業輸出——精細化優勢托舉全球供應鏈。
創新從來離不開工業支撐,尤其是藥品這個“量產即戰斗力”的領域。
多年來,中國在原料藥、仿制藥與高端中間體的全球占比持續上升。2023年原料藥出口超400億美元,占全球近三成,已控制全球仿制藥活性藥物成分(API)供應鏈約80%。凱萊英、藥明康德、華海藥業等企業不斷嵌入默沙東、阿斯利康、BMS的供應鏈,成為其全球商業化不可或缺的一環。
圖 8 2015-2024年中國原料藥出口額變化
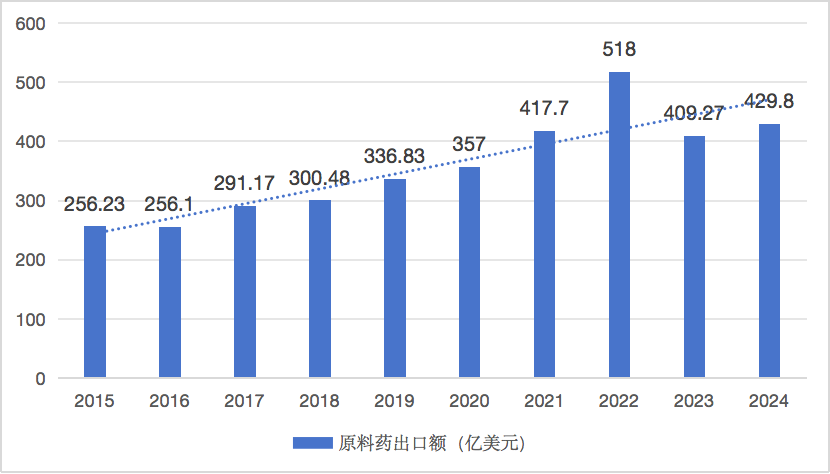
(數據來源:根據中國海關數據整理)
與此同時,“以仿促新”的能力也在悄然升級——石藥通過仿制和API能力切入 AI 聯合創新;藥明康德則由仿制制造升級為承載全球新藥發現的技術平臺,完成“制造—研發—生產—服務”能力的全面躍遷。這些工業能力不僅壓縮了研發成本,更支撐Biotech管線的快速放量與國際交付。
國際化不是“賣斷貨權”,而是輸出標準、占據鏈條——工業輸出是中國創新藥從科技躍遷到產業主導的物質基礎。
三重路徑協同共進:產業模式再平衡。
中國創新藥“出海三路徑”并非并行無交,而是在市場、資本、政策三重動力下互為支撐的系統性戰略。
智力輸出讓國內研發能轉化為全球項目;能力輸出把本土試驗變為國際標簽;工業輸出保障研發成果的放量兌現。三者合力,正在構建一種區別于歐美,但同樣強韌的全球化新范式。這是“中國策源”的系統進化。真正決定產業高度的,不是做哪一段鏈條,而是是否掌握鏈條的重構能力。
五年之問——“青苗”之后,能否長成產業的繁林?
回望2020至2025,中國Biotech經歷了一場驚心動魄的躍遷。融資潮洶涌、交易潮迭起,“青苗”般的早期管線接連授權出海,一批初創企業一躍躋身國際視野。然而,風口過后,也引來一些質疑——這真的是通向繁林的前奏,還是一場短期套利的煙火?
圖 9 2019-2024年中國創新藥市場規模與全球占比
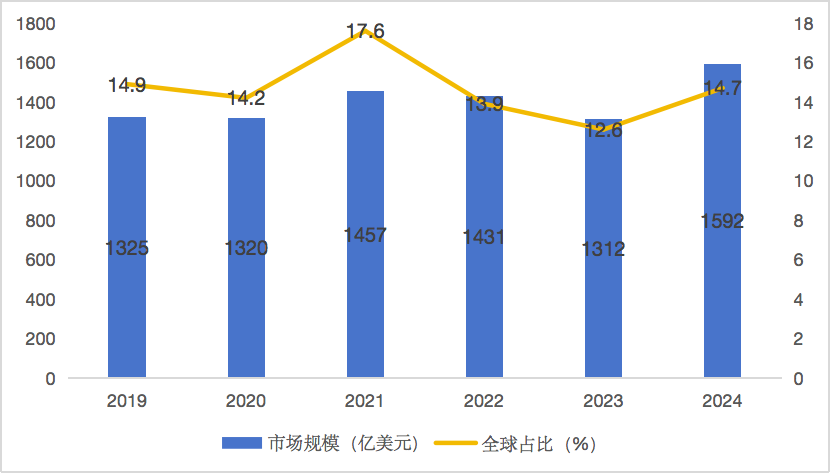
(數據來源:綜合前瞻產業研究院、弗若斯特沙利文等機構)
答案,不應依賴情緒,而要交給事實。
站在2025年這個關鍵節點,我們更應從制度、市場與全球化協作的視角,冷靜審視:今天的BD選擇,是戰略性破局,還是結構性透支?中國創新藥產業,究竟是在“賣青苗”,還是在育林、護林、造林?
我們認為,當前的BD浪潮,是全球醫藥產業分工深化下的理性演化,是中國Biotech在面對資本鏈趨緊、國際壁壘和本土支付體系壓力時的一次有組織、有遠見的戰略跳轉。
授權,不是放棄,而是協同;出海,不是逃避,而是連接。未來五年,才是驗證這一切的關鍵周期。
我們需要的,不是抽象判斷,而是一套可追蹤的實證框架:被授權的項目是否真正完成III期試驗并順利商業化?BD回流的資源是否反哺本土研發形成正循環?工程師紅利與產業基礎是否繼續擴大競爭優勢?中國是否從“管線提供者”成長為全球“策源平臺”?
這些問題的答案,將寫在2026到2030的統計年報里、FDA與EMA的審評公示里,也寫在一個個家庭藥柜中。
創新,從不靠熱詞維系,而靠制度護航;成長,不靠一夜暴富,而靠路徑扎實。我們必須摒棄“快餐式判斷”,給產業更多時間,讓市場、制度和技術三者形成真正的合力閉環。
今天的BD交易,不是被賤賣的“資本標簽”,而是一個系統協同中有韌性、有希望、有遠見的戰略配置點。只要我們守住價值原則、推動制度演進、堅信技術突破,“青苗”爭議終將不只是故事的開頭,而會成為中國創新藥走向全球繁林的根基與脈絡。
為推動中國創新藥成長為“繁林”,我們不僅需優化機制,還需建設性地構建制度與資本體系。中國風險投資自2023年以來出現收縮。在此背景下,亟需引導VC/PE重回早期藥企領域;設立“醫藥創新國家大基金”,參考半導體“國家大基金”模式,為臨床前至注冊階段提供專項資金;與此同時,相關部門已明確恢復未盈利科技型企業(包括生物醫藥類)在科創板、創業板上市通道,應進一步優化機制,允許具備核心技術的生物醫藥企業融資上市;此外,可考慮引導央企與國企通過并購或投資關鍵管線,利用現有政府牽頭基金與政策支持,實現產業整合與資本穩定。上述策略將為中國創新藥產業從政策引導、資本激勵、市場機制到資源整合構筑協同閉環,推動“青苗”向“繁林”的結構性躍升。

















